در این مقاله سایت پاتولوژی شاپ بسعی میکنیم بطور موجز و خلاصه شما را با اصول صحیح فیکساسیون یا تثبیت نمونه ها در آزمایشگاه پاتولوژی آشنا کنیم. تثبیت یا فیکساسیون به عملی گویند که باعث کشتن ناگهانی و یا همزمان سلول های یک بافت شده به طوریکه حتی الامکان شکل و ترکیب سلول ها نسبت به زمان حیات تغییر نکند. بیوپسی ها باید به مدت مناسب داخل فرمالین 10% بمانند. خواص فرمالین بسیار مهم است، بافت باید به طور کاملا باز داخل فرمالین قرار گیرد که نفوذ به طور کامل انجام شود. با ما همراه باشید
مقدمه
چرا فیکساسیون در پاتولوژی «مرحله ساده» نیست؟ در پاتولوژی، بسیاری از خطاهایی که در میکروسکوپ دیده میشوند، ریشه در «قبل از میکروسکوپ» دارند. فیکساسیون، نقطهای است که کیفیت تشخیص را از همان ابتدا شکل میدهد؛ اگر این مرحله درست انجام نشود، حتی بهترین رنگآمیزی و دقیقترین گزارش هم نمیتواند آسیب واردشده به نمونه را کاملاً جبران کند. در عمل، فیکساسیون ضعیف یا نامنظم به
- آرتیفکت
- افت کیفیت مورفولوژی
- تغییر در آنتیژنها (بهویژه برای IHC)
- افزایش تکرار کار
منجر میشود.
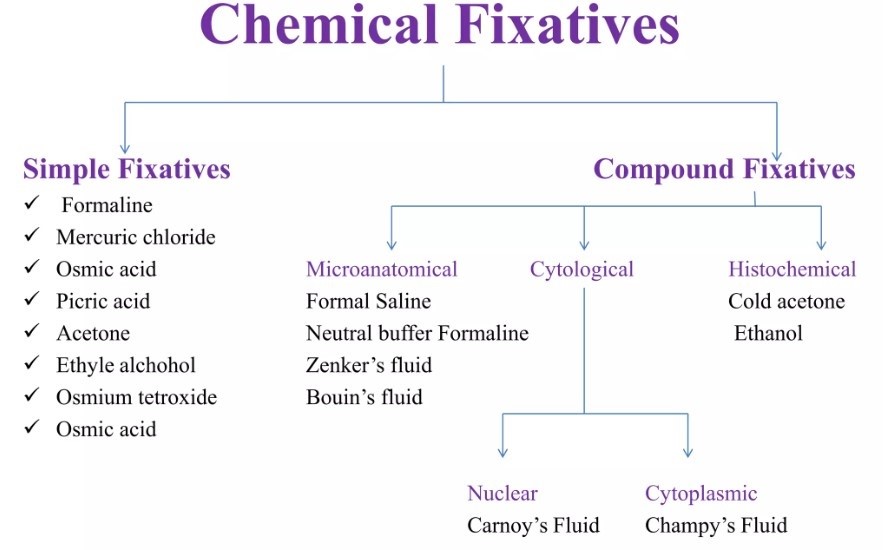
فیکساتیو استاندارد
چرا « 10% Neutral Buffered Formalin » توصیه میشود؟ در اغلب موارد روتین هیستوپاتولوژی، فیکساتیو مرجع « 10% Neutral Buffered Formalin » یا «فرمالین بافر خنثی» است (در عمل معادل حدود ۴٪ فرمالدهید). بسیاری از راهنماهای حرفهای، این گزینه را بهعنوان انتخاب اصلی برای نمونههای روتین معرفی میکنند.
بافر بودن و خنثی بودن اهمیت حیاتی دارد، چون فرمالین اسیدی یا غیر استاندارد میتواند باعث آرتیفکتهای خاص، افت کیفیت رنگآمیزی و حتی اثرگذاری بر نتایج IHC شود. بنابراین «نوع فرمالین» بخشی از کنترل کیفیت است، نه جزئیات حاشیهای.
سه متغیر طلایی فیکساسیون موفق
زمان تا فیکساسیون (Cold Ischemia Time)
به فاصله بین برداشت بافت و قرار گرفتن آن در فیکساتیو، «تأخیر تا فیکساسیون» گفته میشود. برای برخی آزمونها، بهخصوص در بافت پستان برای ER / PR، توصیه میشود این زمان تا حد امکان کوتاه و حتیالامکان کمتر یا مساوی ۱ ساعت باشد، چون تأخیر میتواند کیفیت نتایج را تحت تأثیر قرار دهد.
نکته مدیریتی این است که «زمان تا فیکساسیون» باید قابل ثبت باشد. یعنی اگر نمونه از اتاق عمل یا مرکز دوردست میآید، باید فرایند طوری طراحی شود که تأخیر ثبت و کنترل شود، نه اینکه بعداً حدس زده شود.
نسبت حجم فیکساتیو به حجم بافت
حجم فرمالین باید چندین برابر حجم نمونه باشد تا بافت کاملاً غوطهور بماند و ظرفیت فیکساتیو افت نکند. در راهنماهای عملی، نسبتهایی مانند حداقل ۱۰ به ۱ و حتی بیشتر (در برخی منابع تا ۱۵–۲۰ برابر) ذکر میشود.
اشتباه پرتکرار این است که ظرف کوچک انتخاب میشود یا فرمالین کم ریخته میشود و نمونه بخشی از زمان را نیمهغوطهور میماند. نتیجه میتواند فیکساسیون ناهمگن، لبههای کمفیکس یا حتی خشکشدگی موضعی باشد.
ضخامت نمونه و «قابل نفوذ بودن»
فرمالین برای نفوذ و تثبیت، به زمان نیاز دارد و بافت ضخیم، ریسک کمفیکس شدن عمقی را بالا میبرد. برخی منابع علمی و آموزشی، به حدود «1 mm در ساعت» بهعنوان یک قاعده سرانگشتی اشاره میکنند.
برای نمونههای بزرگ، راهکار عملی این است که برشهای مناسب در زمان Grossing انجام شود یا نمونه بهصورت کنترلشده باز/دو نیم شود تا مسیر نفوذ کوتاهتر گردد.
زمان فیکساسیون
فیکساسیون کم (Under-fixation)
کمفیکس شدن معمولاً با علائم زیر دیده میشود:
- نرم بودن بافت،
- برشهای نامنظم،
- اتولیز،
- رنگپذیری غیر یکنواخت
- ناپایداری در IHC
- افت سیگنال.
در نمونههایی که قرار است مارکرهای حساس گزارش شوند، کمفیکس شدن یک ریسک جدی برای خطای تشخیصی یا اختلاف نتیجه بین نمونههای مختلف است.
فیکساسیون بیش از حد (Over-fixation)
بیشفیکس شدن هم میتواند مشکل ایجاد کند، بهخصوص در آزمونهای آنتیژنی، چون کراسلینکهای زیاد ممکن است دسترسی آنتیبادی به اپیتوپها را کاهش دهد و بازیابی آنتیژن (Antigen Retrieval) را سختتر کند. مدیریت درست این موضوع یعنی داشتن «پنجره زمانی هدف» و ثبت زمان فیکساسیون.
جریان کار پیشنهادی
فیکساسیون استاندارد از پذیرش تا پردازش
گام ۱: پذیرش نمونه با کنترلهای پایه
در پذیرش، سه چیز باید سریع بررسی و ثبت شود: هویت، نوع نمونه، و وضعیت ظرف. ظرف باید مناسب باشد، درپوش مطمئن داشته باشد، نمونه در فرمالین کاملاً غوطهور باشد، و برچسبگذاری کامل باشد.
گام ۲: مدیریت نمونههای بزرگ در Grossing
نمونههای بزرگ، اگر بدون بازکردن یا برش اولیه وارد فرمالین شوند، ممکن است در مرکز توده نمونه کمفیکس بمانند. راهحل عملی، «باز کردن مسیر نفوذ» است: باز کردن احشاء توخالی، برشهای کنترلشده، و کاهش ضخامت مؤثر. برای برخی نمونهها، نباید قبل از مشاهده پاتولوژیست برشهای مخرب انجام شود؛ پس SOP باید دقیق و نقشمحور باشد.
گام ۳: ثبت زمانها و ردیابی
برای نمونههای حساس، ثبت زمانهای کلیدی (برداشت، دریافت، ورود به فیکساتیو) یک ابزار کنترلی است، نه تشریفات. برخی اسناد آموزشی مرتبط با راهنماهای ASCO / CAP نیز روی ثبت این نقاط زمانی تأکید میکنند.
گام ۴: کنترل کیفیت فیکساتیو و ایمنی
فرمالین یک ماده خطرناک است و برچسبگذاری و دسترسی به اطلاعات ایمنی باید جدی گرفته شود. در راهنمای هندلینگ نمونه، به وجود برچسبهای شیمیایی و MSDS اشاره میشود.
خطاهای رایج فیکساسیون در پاتولوژی و اثراتشان
خطای تأخیر طولانی تا فیکساسیون
این خطا معمولاً در انتقال بین مراکز یا اتاق عمل رخ میدهد. پیامد آن اتولیز و تغییرات مولکولی/آنتیژنی است و میتواند روی نتایج ER / PR حساسیت بیشتری نشان دهد. راهکار: تعریف مسیر انتقال، ظرف و فیکساتیو در نقطه برداشت، و ثبت زمان.
خطای ظرف کوچک یا فرمالین کم
وقتی نسبت حجم رعایت نشود، فرمالین «مصرف» میشود و ظرفیتش افت میکند. نتیجه، فیکساسیون ناهمگن است. راهکار: الزام SOP برای حداقل نسبت حجم و آموزش پذیرش نمونه.
خطای نمونه ضخیم و بدون باز کردن مسیر نفوذ
نمونه ضخیم یعنی مرکز نمونه دیر یا ناقص فیکس میشود. در میکروسکوپ، این موضوع میتواند با اختلاف کیفیت از سطح تا عمق دیده شود. راهکار: برشهای کنترلشده در Grossing و تعیین حداکثر ضخامت قابل قبول برای هر نوع نمونه.
خطای فیکساسیون خارج از پنجره زمانی هدف
کمفیکس یا بیشفیکس هر دو مشکل ایجاد میکنند، بهخصوص وقتی IHC و مارکرهای پیشبینیکننده مطرح است. راهکار: تعریف پنجره زمانی، ثبت زمان ورود و خروج از فرمالین، و مستندسازی برای موارد حساس (مثل پستان).
خطای استفاده از فیکساتیو نامناسب یا فرمالین غیر بافر
فرمالین غیر استاندارد میتواند رنگپذیری و کیفیت را خراب کند و باعث آرتیفکت شود. راهکار: کنترل تأمین، تاریخ، غلظت، بافر، و گردش منظم فیکساتیو.
خطای مستندسازی ضعیف
حتی اگر کار درست انجام شده باشد، بدون ثبت و SOP، در اختلاف نتیجه یا ممیزی، دفاعپذیری کاهش مییابد. راهکار: تعریف فرم/فیلدهای ضروری در LIS و الزام ثبت زمانهای کلیدی برای نمونههای حساس.
سخن پایانی
ما در این مقاله سایت پاتولوژی شاپ مختصر کوشیدیم فیکساسیون را در یک جمله ببندیم: فیکساسیون یعنی تبدیل یک نمونه زنده و ناپایدار به یک «شاهد علمی پایدار» برای تشخیص. برای رسیدن به این هدف، باید سهگانه زمان، حجم، و ضخامت را کنترل کنیم، پنجرههای زمانی حساس (مثل پستان و مارکرها) را جدی بگیریم، و ثبت و SOP را بهعنوان بخش واقعی کیفیت ببینیم، نه کاغذبازی. برای درریافت اطلاعات بیشتر و تهیه مواد اولیه مناسب با کارشناسان سایت پاتولوژی شاپ به آدرس https://pathologyshop.com تماس حاصل فرمائید.
سؤالهای پرتکرار (FAQ)
- بهترین فیکساتیو روتین برای هیستوپاتولوژی چیست؟
اغلب راهنماها « 10% Neutral Buffered Formalin » را بهعنوان فیکساتیو توصیهشده برای نمونههای روتین معرفی میکنند.
- نسبت مناسب حجم فرمالین به حجم نمونه چقدر است؟
حداقل ۱۰ به ۱ بهعنوان قاعده رایج مطرح میشود و در برخی راهنماهای عملی حتی ۱۵–۲۰ برابر ذکر شده است.
- چرا ضخامت نمونه مهم است؟
چون نفوذ و تثبیت زمانبر است و نمونه ضخیم در مرکز کمفیکس میماند. برخی منابع به « 1 mm در ساعت » بهعنوان قاعده سرانگشتی اشاره میکنند، با این تأکید که واقعیت پیچیدهتر است.
- «کمفیکس» بودن چه نشانههایی دارد؟
اتولیز، برشهای نامنظم، رنگپذیری ناهمگون و افت کیفیت مورفولوژی؛ و در IHC ناپایداری سیگنال یا نتایج غیر قابل اتکا.
- «بیشفیکس» بودن چه مشکلی ایجاد میکند؟
کراسلینک بیش از حد میتواند دسترسی آنتیژنها را کاهش دهد و به تنظیمات سختتر در بازیابی آنتیژن منجر شود.
- برای ER / PR و HER2 زمان استاندارد فیکساسیون چیست؟
برای نمونههای پستانی که قرار است ER / PR و HER2 بررسی شوند، توصیه میشود در « 10% NBF » حداقل ۶ ساعت و حداکثر ۷۲ ساعت فیکس شوند.
- «Cold Ischemia Time» چقدر باید باشد؟
در راهنماهای مرتبط با ER / PR توصیه میشود زمان تا ورود به فیکساتیو حتیالامکان کوتاه و ≤ ۱ ساعت باشد.
- آیا زمان فیکساسیون باید ثبت شود؟
برای نمونههای حساس، بله. هم برای کنترل کیفیت داخلی و هم برای دفاعپذیری نتیجه.
- آیا ژنراتور یا « UPS » به فیکساسیون ربط دارد؟
بهطور غیر مستقیم بله؛ چون تأخیر در پذیرش، اختلال در پردازش، یا توقف چرخهها میتواند پنجرههای زمانی را به هم بزند و ثبتها را ناقص کند. پایداری عملیات، از تداوم کنترل کیفیت حمایت میکند.
- اگر نمونه از مرکز دوردست ارسال شود، چه کار کنیم؟
راهکارهای رایج شامل قرار دادن نمونه در فرمالین در محل برداشت، دو نیم کردن کنترلشده توده برای نفوذ بهتر، و ثبت زمان برداشت و زمان ورود به فیکساتیو است.
منابع
https://pmc.ncbi.nlm.nih.gov/articles/PMC9624139
https://www.solmedialtd.com/steps-in-tissue-fixation
https://www.slideshare.net/slideshow/fixatives-used-in-histopathology/14696976